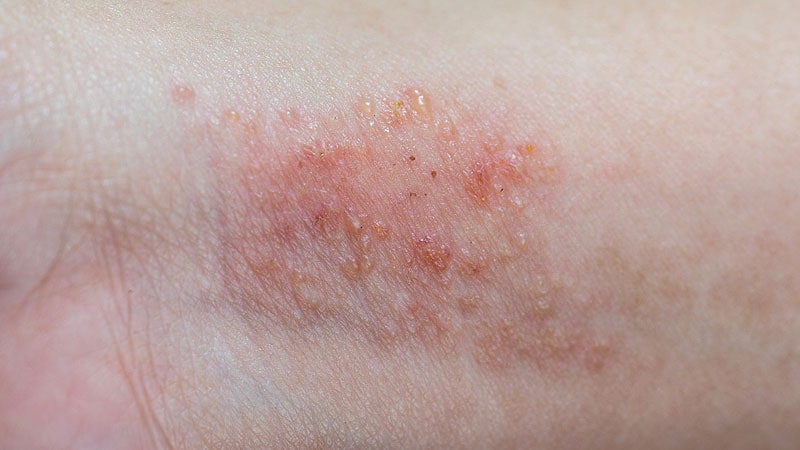
Les patients atteints de dermatite atopique (DA) légère à modérée qui ont été traités avec du brépocitinib topique ont présenté une amélioration significative de leur indice de surface et de gravité de l’eczéma à 6 semaines par rapport à un groupe ayant reçu le véhicule, dans une étude récemment publiée.
Les chercheurs ont déclaré que le brepocitinib, un double inhibiteur expérimental de la tyrosine kinase 2 (TYK2) et de la Janus kinase 1 (JAK1), était efficace et bien toléré chez les patients atteints de DA légère à modérée sur la base des améliorations de plusieurs mesures, y compris l’indice de surface et de gravité de l’eczéma ( EASI) score total et taux de réponse à l’évaluation globale de l’investigateur (IGA). Le brepocitinib a également réduit les symptômes de prurit dès 2 jours après le début du traitement, ont-ils noté.
“Cette étude soutient l’évaluation plus approfondie du brépocitinib topique en tant que nouveau traitement de la MA légère à modérée”, ont écrit Megan N. Landis, MD, du département de médecine de l’Université de Louisville (Ky.) et ses collègues dans l’étude publiée dans le British Journal of Dermatology.
Ils ont évalué le brépocitinib dans une étude de phase 2b, en double aveugle, à dosage variable, au cours de laquelle 292 patients ont été randomisés pour recevoir du brépocitinib une fois par jour (brépocitinib 0,1 %, 0,3 %, 1,0 %, 3,0 %) ou deux fois par jour (brépocitinib 0,3 %, 1,0 % ), ou véhicule pendant 6 semaines. À 6 semaines, les chercheurs ont évalué le score total EASI comme résultat principal, un score IGA de 0 ou 1 comme résultat secondaire. L’âge moyen des patients était de 40 ans (extrêmes, 13-74), près de 60 % étaient blancs, 17,5 % étaient noirs et environ 20 % étaient asiatiques.
Comparativement au groupe de véhicule correspondant une fois par jour (réduction moyenne des moindres carrés de -44,4 ; intervalle de confiance à 90 %, de -57,3 à -31,6) et au groupe de véhicule à deux prises par jour (LSM, -47,6 ; IC à 90 %, de -57,5 à – 37,7), le groupe brepocitinib 1 % une fois par jour (LSM, -70,1 ; IC à 90 %, -82,1 à -58,0) et le groupe deux fois par jour (LSM, -75,0 ; IC à 90 %, -83,8 à -66,2) réductions en pourcentage du score total EASI par rapport à la ligne de base à 6 semaines. Les patients des autres groupes de dose de brepocitinib ont présenté des réductions non significatives de l’EASI par rapport au départ.
En ce qui concerne les critères de jugement secondaires, un pourcentage significativement plus élevé de patients dans cinq des six groupes de traitement actif ayant obtenu un score IGA de 0 ou 1 et au moins une réduction de 2 points du score IGA dans le groupe brepocitinib à 0,1 % une fois par jour (29,7 % ; IC à 90 %, 18,5 %-43,3 %), groupe de 0,3 % (33,3 % ; IC à 90 %, 21,3 %-47,0 %), groupe de 1,0 % (40,5 % ; IC à 90 %, 28,0 %-54,4 %), 3,0 % (44,4 % ; IC à 90 %, 30,2 % à 59,1 %) et le groupe brépocitinib à 0,3 % deux fois par jour (33,3 % ; IC à 90 %, 21,3 % à 47,0 %) par rapport au groupe à prise unique quotidienne (10,8 % ; 90 % IC, 4,8 %-22,2 %) et deux fois par jour (13,9 % ; IC 90 %, 6,9 %-25,4 %).
Les auteurs de l’étude ont noté que 37,0 % des patients dans l’ensemble ont présenté des événements indésirables liés au traitement (TEAE), la plupart des TEAE survenant dans le véhicule une fois par jour (48,6 %), le véhicule deux fois par jour (47,2 %) et le brepocitinib 0,1 % (45,9 %). Les événements indésirables n’ont pas été considérés comme dépendants de la dose, et aucun groupe n’a présenté d’EIAT graves ou de décès.
La rhinopharyngite et l’aggravation de la MA étaient les EIAT les plus fréquemment signalés, avec environ 8 % des personnes dans les groupes de véhicules présentant une aggravation de la MA.
Le brépocitinib est également actuellement développé comme traitement de la dermatomyosite, du lupus érythémateux disséminé, de l’hidrosadénite suppurée et de l’uvéite non infectieuse par Priovant Therapeutics, une société fondée par Pfizer et Roivant Sciences.
En septembre 2021, la Food and Drug Administration a approuvé la crème topique de ruxolitinib pour le traitement des patients atteints de dermatite atopique légère à modérée âgés de 12 ans et plus, le premier inhibiteur topique de JAK approuvé pour la MA.
Cette étude a été sponsorisée par Pfizer. Les auteurs ont fait état de relations personnelles et institutionnelles sous la forme de postes d’investigateur, d’honoraires, d’honoraires, de subventions de recherche, de postes d’employés et de détention d’actions ou d’actions pour diverses sociétés pharmaceutiques, des sciences de la vie et de biotechnologie.
Cet article a été initialement publié sur MDedge.com, qui fait partie du réseau professionnel Medscape.