Les régulateurs américains ont autorisé des boosters COVID-19 mis à jour, les premiers à cibler directement la souche d’omicron la plus courante d’aujourd’hui
Les régulateurs américains ont autorisé des boosters COVID-19 mis à jour, les premiers à cibler directement la souche d’omicron la plus courante d’aujourd’hui
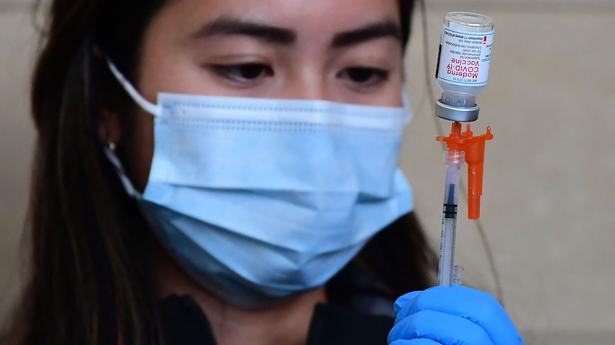
Les États-Unis ont autorisé mercredi leur première mise à jour des vaccins COVID-19, des doses de rappel qui ciblent la souche omicron la plus courante à ce jour. Les tirs pourraient commencer dans quelques jours.
La décision de la Food and Drug Administration modifie la recette des injections faites par Pfizer et son rival Moderna qui ont déjà sauvé des millions de vies. L’espoir est que les boosters modifiés atténueront encore une autre poussée hivernale – et aideront à atténuer le parent BA.5 omicron qui continue de se propager largement.
“Ces boosters mis à jour nous offrent une opportunité de devancer” la prochaine vague de COVID-19, a déclaré le commissaire de la FDA, le Dr Robert Califf.
Jusqu’à présent, les vaccins COVID-19 ciblaient la souche de coronavirus d’origine, même si des mutants extrêmement différents ont émergé. Les nouveaux boosters américains sont des tirs combinés ou “bivalents”. Ils contiennent la moitié de la recette originale du vaccin et la moitié de la protection contre les dernières versions d’omicron, BA.4 et BA.5, qui sont considérées comme les plus contagieuses à ce jour.
La combinaison vise à augmenter la protection croisée contre plusieurs variantes.
“Cela offre vraiment la plus large opportunité de protection”, a déclaré Annaliesa Anderson, responsable des vaccins chez Pfizer, à l’Associated Press.
Les rappels mis à jour sont uniquement destinés aux personnes qui ont déjà reçu leurs primovaccinations, en utilisant les vaccins d’origine. Les doses fabriquées par Pfizer et son partenaire BioNTech sont destinées à toute personne de 12 ans et plus, tandis que les vaccins mis à jour de Moderna sont destinés aux adultes – s’il s’est écoulé au moins deux mois depuis leur dernière primo-vaccination ou leur dernier rappel. Ils ne doivent pas être utilisés pour les premières vaccinations.
Il reste une étape avant le début d’une campagne de rappel d’automne : les Centers for Disease Control and Prevention doivent recommander qui doit recevoir le vaccin supplémentaire. Un comité consultatif influent du CDC débattra des preuves jeudi – y compris si les personnes à haut risque de COVID-19 devraient passer en premier.
Les États-Unis ont acheté plus de 170 millions de doses aux deux sociétés. Pfizer a déclaré qu’il pourrait expédier jusqu’à 15 millions de ces doses d’ici la fin de la semaine prochaine. Moderna n’a pas immédiatement indiqué combien de doses sont prêtes à être expédiées, mais que certaines seront disponibles “dans les prochains jours”.
La grande question est de savoir si les gens lassés des vaccinations vont à nouveau se retrousser les manches. Seulement la moitié des Américains vaccinés ont reçu la première dose de rappel recommandée, et seulement un tiers des personnes de 50 ans et plus qui ont été invitées à recevoir un deuxième rappel l’ont fait.
Voici le hic : les vaccins originaux offrent toujours une forte protection contre les maladies graves et la mort par COVID-19 pour les personnes généralement en bonne santé, surtout si elles ont reçu cette première dose de rappel importante. On ne sait pas à quel point un rappel mis à jour apportera plus d’avantages – au-delà d’un saut temporaire d’anticorps capables de repousser une infection omicron.
Pourtant, “les gens doivent réaliser qu’il s’agit d’un type de booster différent de celui qui était disponible auparavant. Cela fonctionnera mieux pour protéger contre l’omicron », a déclaré le virologue Andrew Pekosz de la Johns Hopkins Bloomberg School of Public Health.
Même les personnes qui avaient une version antérieure d’omicron peuvent toujours être réinfectées, donc “vous devriez absolument opter pour le rappel même si vous avez été infecté l’année dernière”, a ajouté Pekosz. Il pense que “si nous pouvons obtenir une bonne adhésion pour utiliser cela, nous pourrions vraiment faire une brèche” dans les cas de COVID-19.
La FDA a autorisé les modifications avant les études sur les personnes, une étape vers la gestion éventuelle des mises à jour du vaccin COVID-19 plus comme des modifications annuelles des vaccins antigrippaux.
Le chef des vaccins de la FDA, le Dr Peter Marks, a souligné que l’agence considérait «la totalité» des preuves. Pfizer et Moderna ont déjà préparé des doses de vaccin mises à jour pour correspondre aux mutants antérieurs – y compris la souche omicron nommée BA.1 qui a frappé l’hiver dernier – et les ont testés chez l’homme. Ces changements de recette antérieurs étaient sûrs et la version BA.1 a considérablement augmenté les anticorps anti-virus – plus qu’une autre dose du vaccin original – bien que moins que ceux qui reconnaissaient les souches BA.4 et BA.5 génétiquement distinctes d’aujourd’hui.
Mais au lieu d’utiliser ces vaccins BA.1, la FDA a ordonné aux entreprises de préparer des doses encore plus à jour qui ciblent ces nouveaux mutants omicron, déclenchant une course pour les déployer. Plutôt que d’attendre quelques mois de plus pour des études humaines supplémentaires de cette modification de recette très similaire, Marks a déclaré que les tests sur les animaux ont montré que la dernière mise à jour stimule “une très bonne réponse immunitaire”.
“Il faut rafraîchir le système immunitaire avec ce qui circule réellement”, a déclaré Marks. C’est pourquoi la FDA n’autorise plus les boosters fabriqués avec la recette originale pour les 12 ans et plus.
L’espoir, a déclaré Marks, est qu’un vaccin adapté aux variantes qui se propagent actuellement puisse mieux combattre l’infection, pas seulement les maladies graves, au moins pendant un certain temps.
Et après? Alors même que des plans modifiés se déploient, Moderna et Pfizer mènent des études sur l’homme pour aider à évaluer leur valeur, y compris leur résistance si un nouveau mutant se présente.
Et pour les enfants, Pfizer prévoit de demander à la FDA d’autoriser les boosters mis à jour pour les 5 à 11 ans début octobre.
Il s’agit de la première mise à jour américaine de la recette du vaccin COVID-19, une prochaine étape importante mais attendue – comme la façon dont les vaccins contre la grippe sont mis à jour chaque année.
Et les États-Unis ne sont pas seuls. La Grande-Bretagne a récemment décidé d’offrir aux adultes de plus de 50 ans une option de rappel différente de Moderna, un coup combiné ciblant cette souche BA.1 omicron initiale. Les régulateurs européens réfléchissent à l’opportunité d’autoriser une ou les deux formules mises à jour.



![Les Ukrainiens ont abattu un bombardier russe Tu-22M3 [FILM]](https://i.iplsc.com/-/000IZDN0G9VPYOKR-C411.jpeg)




