En décembre 2020, une semaine avant que le cardiologue Stuart Katz ne reçoive son premier vaccin COVID-19, il a eu de la fièvre. Il a passé les deux semaines suivantes ravagé par une toux, des courbatures et des frissons. Après des mois à aider les autres à surmonter la pandémie, Katz, qui travaille à l’Université de New York, avait sa propre expérience de première main de COVID-19.
Le jour de Noël, la maladie aiguë de Katz s’est finalement calmée. Mais de nombreux symptômes persistaient, dont certains liés à l’organe autour duquel il a construit sa carrière : le cœur. Monter deux volées d’escaliers le couperait le souffle, son cœur battant à 120 battements par minute. Au cours des mois suivants, il a commencé à se sentir mieux et il a maintenant repris sa routine normale de marche et de vélo. Mais les rapports sur les effets du COVID-19 sur le système cardiovasculaire l’ont rendu préoccupé par sa santé à long terme. « Je me dis : ‘Eh bien, c’est vraiment fini ?’ », raconte Katz.
Dans une étude cette année, les chercheurs ont utilisé les dossiers du Département américain des anciens combattants (VA) pour estimer la fréquence à laquelle le COVID-19 entraîne des problèmes cardiovasculaires. Ils ont découvert que les personnes qui avaient eu la maladie faisaient face à des risques considérablement accrus pour 20 maladies cardiovasculaires – y compris des problèmes potentiellement catastrophiques tels que des crises cardiaques et des accidents vasculaires cérébraux – dans l’année suivant l’infection par le coronavirus SARS-CoV-2. Les chercheurs disent que ces complications peuvent survenir même chez les personnes qui semblent s’être complètement remises d’une infection bénigne.
Certaines études plus petites ont reflété ces résultats, mais d’autres trouvent des taux de complications plus faibles. Alors que des millions, voire des milliards de personnes ont été infectées par le SRAS-CoV-2, les cliniciens se demandent si la pandémie sera suivie d’une réplique cardiovasculaire. Pendant ce temps, les chercheurs tentent de comprendre qui est le plus à risque de ces problèmes cardiaques, combien de temps le risque persiste et ce qui cause ces symptômes.
C’est un trou béant dans un domaine important de la santé publique, dit Katz. “Nous ne comprenons pas si cela modifie la trajectoire à vie du risque de crise cardiaque, d’accident vasculaire cérébral ou d’autres événements cardiaques – nous ne le savons tout simplement pas.” Ici, Nature examine les questions que se posent les scientifiques et les réponses qu’ils ont découvertes jusqu’à présent.
Combien de personnes sont à risque ?
Les médecins ont signalé des problèmes cardiovasculaires liés au COVID-19 tout au long de la pandémie, mais les inquiétudes à ce sujet ont augmenté après la publication des résultats de l’étude VA plus tôt cette année. L’analyse de Ziyad Al-Aly, épidémiologiste à l’Université de Washington à St. Louis, Missouri, et ses collègues est l’un des efforts les plus étendus pour caractériser ce qui arrive au cœur et au système circulatoire après la phase aiguë de COVID-19. Les chercheurs ont comparé plus de 150 000 anciens combattants qui s’étaient remis d’un COVID-19 aigu avec leurs pairs non infectés, ainsi qu’avec un groupe témoin pré-pandémique.
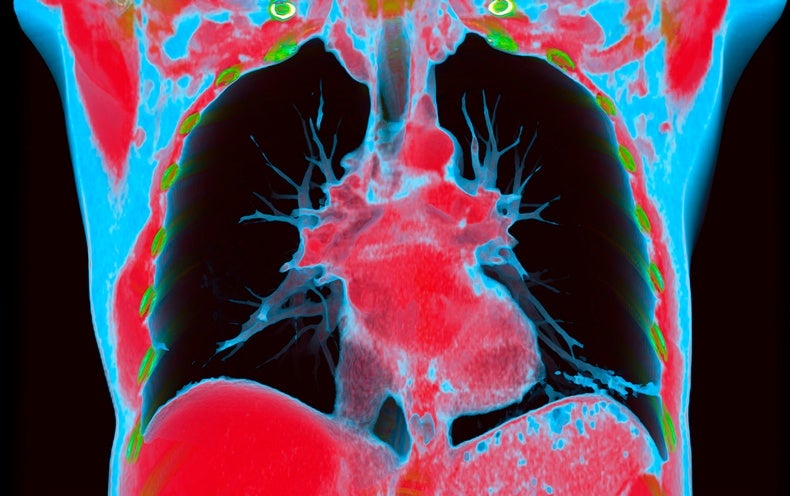
Les personnes qui avaient été admises aux soins intensifs avec des infections aiguës avaient un risque considérablement plus élevé de problèmes cardiovasculaires au cours de l’année suivante (voir « Problèmes cardiaques »). Pour certaines conditions, telles que le gonflement du cœur et les caillots sanguins dans les poumons, le risque a été multiplié par au moins 20 par rapport à celui des pairs non infectés. Mais même les personnes qui n’avaient pas été hospitalisées présentaient des risques accrus de nombreuses affections, allant d’une augmentation de 8 % du taux de crises cardiaques à une augmentation de 247 % du taux d’inflammation cardiaque.
Pour Al-Aly, l’étude a ajouté au nombre croissant de preuves qu’un épisode de COVID-19 peut altérer de façon permanente la santé de certaines personnes. Ces types de changement entrent dans la catégorie des séquelles post-aiguës de COVID-19, qui couvre les problèmes qui émergent après une première infection. Ce trouble comprend – et chevauche – la condition persistante connue sous le nom de long COVID, un terme qui a de nombreuses définitions.
Des études indiquent que le coronavirus est associé à un large éventail de problèmes durables, tels que le diabète, des lésions pulmonaires persistantes et même des lésions cérébrales. Comme pour ces conditions, Al-Aly dit que les problèmes cardiovasculaires qui surviennent après une infection par le SRAS-CoV-2 peuvent diminuer la qualité de vie d’une personne à long terme. Des traitements existent pour ces problèmes, « mais ce ne sont pas des conditions curables », ajoute-t-il.
Malgré sa grande taille, l’étude VA s’accompagne de mises en garde, selon les chercheurs. L’étude est observationnelle, ce qui signifie qu’elle réutilise des données qui ont été collectées à d’autres fins – une méthode qui peut introduire des biais. Par exemple, l’étude ne considère que les anciens combattants, ce qui signifie que les données sont biaisées en faveur des hommes blancs. “Nous n’avons pas vraiment d’étude comme celle-ci qui porte sur une population plus diversifiée et plus jeune”, déclare Eric Topol, génomique chez Scripps Research à La Jolla, en Californie. Il pense que davantage de recherches sont nécessaires avant que les scientifiques puissent vraiment quantifier la fréquence à laquelle les problèmes cardiovasculaires surviennent.
Daniel Tancredi, statisticien médical à l’Université de Californie à Davis, souligne une autre source potentielle de biais. L’un des groupes témoins de l’étude VA a dû passer plus d’un an sans attraper le SRAS-CoV-2 pour être inclus dans l’étude. Il pourrait y avoir des différences physiologiques qui rendraient le groupe témoin moins susceptible de contracter la maladie, ce qui pourrait également affecter sa susceptibilité aux problèmes cardiovasculaires. Pourtant, Tancredi pense que l’étude a été bien conçue et que tout biais est susceptible d’être minime. « Je ne dirais pas que ces chiffres sont tout à fait exacts, mais ils sont certainement dans le stade approximatif », dit-il. Il espère que de futures études prospectives permettront d’affiner les estimations d’Al-Aly.
Certaines autres études vont dans le même sens. Les données du système de santé anglais, par exemple, montrent que les personnes hospitalisées avec le COVID-19 étaient environ trois fois plus susceptibles que les personnes non infectées de faire face à des problèmes cardiovasculaires majeurs dans les huit mois suivant leur hospitalisation. Une deuxième étude a révélé que, dans les 4 mois suivant l’infection, les personnes qui avaient eu le COVID-19 avaient un risque environ 2,5 fois plus élevé d’insuffisance cardiaque congestive par rapport à celles qui n’avaient pas été infectées.
La modélisatrice de la santé Sarah Wulf Hanson de l’Institute for Health Metrics and Evaluation de l’Université de Washington à Seattle a utilisé les données d’Al-Aly pour estimer le nombre de crises cardiaques et d’accidents vasculaires cérébraux auxquels le COVID-19 a été associé. Son travail non publié suggère qu’en 2020, les complications après COVID-19 ont causé 12 000 accidents vasculaires cérébraux supplémentaires et 44 000 crises cardiaques supplémentaires aux États-Unis, des chiffres qui ont bondi jusqu’à 18 000 accidents vasculaires cérébraux et 66 000 crises cardiaques en 2021. Cela signifie que COVID-19 pourrait avoir augmenté les taux de crise cardiaque d’environ 8 % et d’accident vasculaire cérébral d’environ 2 %. « Cela donne à réfléchir », dit Wulf Hanson.
Les effets indirects de la pandémie de COVID-19, tels que les rendez-vous médicaux manqués, le stress et la nature sédentaire de l’isolement à domicile ont probablement contribué davantage au fardeau cardiovasculaire de nombreuses personnes, suggèrent les scientifiques.
Cependant, ces chiffres ne correspondent pas à ce que certains chercheurs ont vu en clinique. Dans une petite étude de 52 personnes, Gerry McCann, un spécialiste de l’imagerie cardiaque à l’Université de Leicester, au Royaume-Uni, et ses collègues ont découvert que les personnes qui s’étaient rétablies après avoir été hospitalisées avec COVID-19 n’avaient pas de taux de maladie cardiaque plus élevé qu’un groupe de personnes qui avaient des conditions sous-jacentes similaires mais qui sont restées non infectées. L’essai était d’un ordre de grandeur inférieur à celui d’Al-Aly, mais McCann et ses collègues travaillent sur une étude plus vaste avec environ 1 200 participants. Les résultats n’ont pas encore été publiés, mais McCann dit que “plus nous acquérons de données, moins nous sommes impressionnés par le degré, disons, de lésions myocardiques” ou de problèmes cardiaques.
Bien qu’ils aient une image incomplète des effets cardiovasculaires du COVID-19, les médecins recommandent la prudence. Un groupe d’experts réuni par l’American College of Cardiology conseille aux médecins de tester les personnes qui ont eu le COVID-19 pour des problèmes cardiovasculaires si elles présentent des facteurs de risque tels que le fait d’être plus âgé ou immunodéprimé.
Comment les chercheurs recueillent-ils plus d’informations ?
Les réponses à de nombreuses questions sur les impacts à long terme du COVID-19 pourraient provenir d’une vaste étude appelée le projet Researching COVID to Enhance Recovery, ou RECOVER, qui vise à suivre 60 000 personnes pendant jusqu’à 4 ans sur plus de 200 sites dans les États Unis. L’étude inclura des participants avec un long COVID, des personnes qui ont été infectées et qui se sont rétablies, et d’autres qui n’ont jamais été infectées. “Il s’inscrit tout au long de la vie”, explique Katz, qui est l’investigateur principal de l’essai. Lui et ses collègues prévoient d’étudier les enfants, les adultes, les femmes enceintes et les nourrissons nés pendant l’essai.
La plupart des participants à RECOVER rempliront des questionnaires sur leur santé et subiront des tests non invasifs. Les chercheurs visent à collecter des informations supplémentaires pour environ 20% des participants, par exemple en insérant temporairement de petits tubes dans le cœur des adultes pour obtenir des mesures localisées d’indicateurs tels que la pression artérielle et les niveaux d’oxygène. Après plusieurs années, les scientifiques espèrent avoir complété un catalogue des symptômes du long COVID, avoir compris qui les développe et commencé à comprendre pourquoi ils se produisent.
Au Royaume-Uni, McCann dirige le groupe de travail cardiovasculaire pour un projet similaire appelé l’étude post-hospitalisation COVID-19, ou PHOSP-COVID. Cette étude multicentrique se concentre sur les personnes hospitalisées avec la COVID-19 et vise à découvrir la prévalence des symptômes persistants, qui est le plus à risque et comment le virus cause des problèmes de santé persistants. Jusqu’à présent, le groupe a constaté que seulement environ un quart des personnes hospitalisées se sentaient complètement rétablies un an après l’infection. Et l’équipe a identifié des marqueurs immunitaires associés aux pires cas de COVID longs.
Comment le virus nuit-il au cœur?
L’effet du COVID-19 sur le cœur pourrait être lié à la protéine clé que le virus utilise pour pénétrer dans les cellules. Il se lie à une protéine appelée ACE2, qui se trouve à la surface de dizaines de types de cellules humaines. Cela, dit Al-Aly, lui donne “l’accès et la permission d’entrer dans presque toutes les cellules du corps”.
Lorsque le virus pénètre dans les cellules endothéliales qui tapissent les vaisseaux sanguins, dit Topol, c’est probablement là que de nombreux problèmes cardiovasculaires commencent. Des caillots sanguins se forment naturellement pour guérir les dommages causés pendant que le corps élimine l’infection. Ces caillots peuvent obstruer les vaisseaux sanguins, entraînant des dommages aussi mineurs qu’une douleur à la jambe ou aussi graves qu’une crise cardiaque. Une étude basée sur plus de 500 000 cas de COVID-19 a révélé que les personnes qui avaient été infectées avaient un risque 167% plus élevé de développer un caillot sanguin dans les deux semaines suivant l’infection que les personnes qui avaient eu la grippe. Robert Harrington, cardiologue à l’Université de Stanford en Californie, dit que même après l’infection initiale, des plaques peuvent s’accumuler là où la réponse immunitaire a endommagé la muqueuse des vaisseaux sanguins, provoquant le rétrécissement des vaisseaux. Cela peut entraîner des problèmes, tels que des crises cardiaques et des accidents vasculaires cérébraux, même des mois après la guérison de la plaie initiale. “Ces complications précoces peuvent certainement se traduire par des complications ultérieures”, déclare Harrington.
Le SRAS-CoV-2 pourrait également laisser ses empreintes digitales sur le système immunitaire. Lorsqu’Akiko Iwasaki, immunologiste à l’Université de Yale à New Haven, Connecticut, et ses collègues ont caractérisé les anticorps de personnes hospitalisées pendant la phase aiguë de COVID-19, ils ont trouvé une pléthore d’anticorps contre les tissus humains. Iwasaki soupçonne que lorsque le SRAS-CoV-2 renforce le système immunitaire de quelqu’un, il peut activer par inadvertance des cellules immunitaires qui attaquent le corps – des cellules qui restent silencieuses lorsque le système immunitaire n’est pas en surmultiplication. Ces cellules immunitaires pourraient endommager de nombreux organes, dont le cœur.
Les dommages aux vaisseaux sanguins peuvent aggraver les attaques contre le système immunitaire. “Vous pouvez penser que ces dommages s’accumulent au fil du temps”, explique Iwasaki. Lorsque le système cardiovasculaire a été agressé sur suffisamment de fronts, c’est à ce moment-là que les gens peuvent subir des conséquences graves, comme un accident vasculaire cérébral ou une crise cardiaque.
Qu’en est-il de la réinfection et des nouvelles variantes ?
Les vaccinations, les réinfections et la variante Omicron du SRAS-CoV-2 posent toutes de nouvelles questions sur les effets cardiovasculaires du virus. Un article publié en mai par Al-Aly et ses collègues suggère que la vaccination réduit, mais n’élimine pas, le risque de développer ces problèmes à long terme.
Hanson est également désireux de modéliser si les réinfections aggravent le risque et si la variante relativement bénigne – mais répandue – d’Omicron affectera le système cardiovasculaire aussi radicalement que les autres variantes. “Nous sommes un peu en train de mâcher le morceau pour les données de suivi parmi les cas d’Omicron”, dit-elle.
Cet article est reproduit avec autorisation et a été publié pour la première fois le 2 août 2022.