Le parcours vers un lot final, appelé « lot » de 300 000 à 600 000 flacons de vaccin final, nécessite que les opérations soient effectuées dans plusieurs installations dotées d’équipements sophistiqués et d’un personnel hautement qualifié. Le vaccin est fabriqué et testé en étapes séparées, en commençant par la matrice d’ADN, suivie de l’ARNm et enfin de l’ARNm encapsulé dans un LNP stérile filtré dans les flacons en verre à distribuer. Pour s’assurer que chaque lot est de qualité constante, quel que soit l’endroit où il a été fabriqué et testé, il est essentiel de comprendre ce qui est important pour le produit. Cette étape fondamentale implique les attributs de qualité critiques (CQA) d’un vaccin – ces propriétés qui garantissent l’innocuité et l’efficacité5. Ces AQC sont testés plusieurs fois au cours de la production d’un lot et soumis à plusieurs niveaux de contrôles de processus qui sont documentés dans les enregistrements de production, examinés par le personnel d’assurance qualité et définis dans l’autorisation ou la licence réglementaire.
Les CQA des vaccins à ARNm concernent l’identité et la qualité de la matrice d’ADN et de l’ARNm, la qualité de la nanoparticule lipidique et la capacité de l’ARNm à être systématiquement traduit en protéine de pointe. Chaque lot d’ARNm-LNP doit répondre à des critères prédéterminés dans plus de 40 tests distincts pour la libération du produit. Chaque méthode analytique devait être développée pour un CQA unique, ainsi que des étapes de processus spécifiques, pour démontrer le contrôle et la cohérence de la fabrication. Pour qu’un laboratoire de contrôle de la qualité soit qualifié pour effectuer des tests de produits, tous les équipements, méthodes et analyses de données doivent s’avérer corrects, et les données doivent être reliées entre les laboratoires pour garantir des résultats cohérents. De plus, de nombreux lots de matrice d’ADN, d’ARN et de vaccin final sont soumis à des études de stabilité contrôlées, conçues pour tester ces 40+ attributs à plusieurs moments pendant le stockage du vaccin, afin de définir une date de péremption acceptable. Il s’agissait d’un défi particulier car les données de stabilité en temps réel étaient générées juste à temps et l’équipe Pfizer devait gérer les périodes d’expiration des produits sur la base des données disponibles et des autorisations réglementaires. En raison du nombre de laboratoires et d’installations de fabrication impliqués, plus de 50 études de stabilité distinctes ont été mises en place au cours de la seule première année de fabrication du vaccin COVID-19.
Nous avons développé des processus à grande échelle pour l’ADN plasmidique et l’ARNm afin de permettre des approvisionnements cliniques de stade avancé tout en planifiant, en parallèle, une production à grande échelle dans le but de répondre aux besoins de la population mondiale. En outre, nous avons à la fois intensifié et étendu le processus de fabrication de LNP à petite échelle pour garantir un produit médicamenteux adéquat tout en réduisant le risque de problèmes de comparabilité entre les échelles de production. Par exemple, la mise à l’échelle du processus d’ARNm IVT de l’échelle du laboratoire (500 ml) à l’échelle de la production (40 L et 128 L) a nécessité une série de conceptions techniques pour assurer une mise à l’échelle cohérente ainsi que des contrôles et des tests rigoureux en cours de processus. pour établir que le processus à grande échelle est contrôlé et représente le processus à petite échelle (Fig. 2). Ces grandes tailles de lots (jusqu’à 600 000 flacons par lot) sont encore amplifiées par l’utilisation de flacons multi-usages, ce qui permet de produire jusqu’à 3,6 millions de doses par lot. La cohérence du processus et de la qualité de l’ARNm est essentielle pour démontrer la comparabilité, ainsi que pour donner l’assurance que la fabrication à l’échelle commerciale fournit un produit conforme à celui évalué au cours des essais cliniques. De même, la mise à l’échelle et la mise à l’échelle du processus LNP étaient particulièrement difficiles car nous ne souhaitions pas augmenter les dimensions internes de l’appareil qui crée l’ARNm-LNP (appelé mélangeur en T ou mélangeur à jet impactant). La mise à l’échelle nous a permis de créer les TNL en utilisant une géométrie de mélangeur en T cohérente quelle que soit l’échelle, minimisant ainsi le risque de changements liés à l’échelle dans les caractéristiques des TNL. Pour permettre une plus grande production, jusqu’à huit ensembles de pompes et de mélangeurs en T ont été utilisés sur une seule ligne de fabrication, avec un contrôleur central, pour s’assurer que la qualité des PNL à grande échelle était comparable à celle des plus petits, à l’échelle clinique précoce. TNL.
L’échelle de production du plasmide, de la substance médicamenteuse (DS) et du produit médicamenteux (DP) à base d’ARNm a été multipliée par 1 000.
L’autorisation d’utilisation d’urgence initiale autorisait la fabrication sur cinq sites : un seul nœud pour le plasmide d’ADN (Chesterfield, Missouri), deux nœuds pour la substance médicamenteuse à ARNm (Andover, Massachusetts et Mayence et Rentschler, Allemagne) et quatre nœuds pour la fabrication de LNP (deux BioNTech organisations de fabrication sous contrat ; Kalamazoo, Michigan ; et Puurs, Belgique). Les tests de contrôle de la qualité ont été pris en charge par des laboratoires centraux polyvalents à Chesterfield et Andover, ainsi que par les laboratoires locaux prenant en charge chaque établissement. Le vaccin COVID-19 est désormais fabriqué et testé dans 20 sites du réseau Pfizer et BioNTech (Fig. 3).
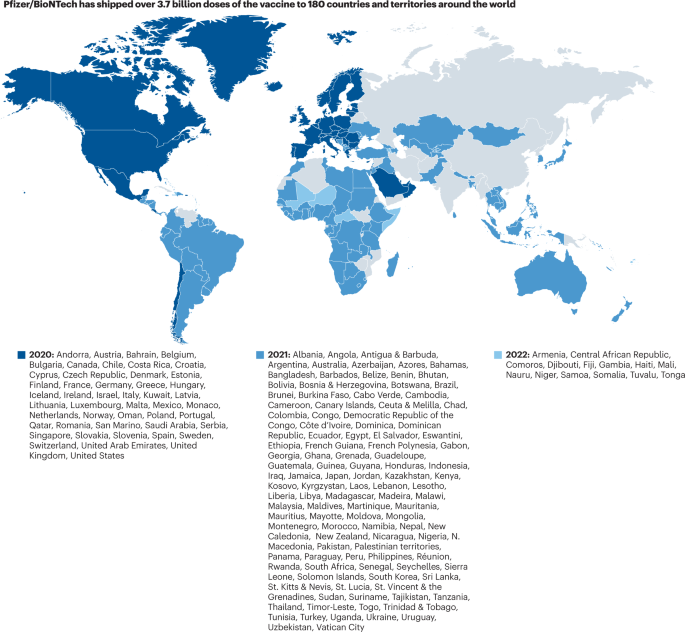
Jusqu’en 2022, Pfizer a distribué dans le monde plus de 3,7 milliards de doses dans 180 pays et territoires.
Chaque changement, ainsi que l’introduction de nouveaux fournisseurs ou des exercices de mise à l’échelle, se traduit par un ensemble de données et de documents qui doivent être soumis à tous les pays qui ont autorisé ou approuvé le vaccin, nécessitant à tout moment des centaines de collègues travaillant sur la rédaction de la documentation réglementaire et d’examen, ainsi que de répondre aux questions des organismes de réglementation. Concevoir, mettre en œuvre et approuver les changements nécessaires pour garantir la poursuite de la fabrication ou des tests de vaccins reste aujourd’hui un énorme effort de gestion du cycle de vie. En tirant parti de centaines de collègues expérimentés à travers notre réseau mondial, nous avons pu gérer ces changements et répondre aux attentes réglementaires, ainsi que répondre à la demande de millions de flacons sans compromettre les délais de fabrication et de livraison.
Alors que tous ces processus – mise à l’échelle ou élargissement, tests, validation, comparabilité et transferts – font partie de la fabrication de tout vaccin de qualité, l’ampleur, l’échelle et la vitesse à laquelle ils ont été mis en œuvre étaient sans précédent. L’engagement et la collaboration avec les autorités réglementaires mondiales ont été remarquables car nous partagions un objectif commun de recherche d’une solution vaccinale à la pandémie de COVID-19. Il y a eu une collaboration, des discussions pendant la nuit et pendant les vacances, et des transferts accélérés de méthodes vers des laboratoires mondiaux. Des scientifiques, des ingénieurs, des collègues chargés de la réglementation et le personnel des agences de réglementation ont travaillé sept jours sur sept pour accélérer les soumissions et les examiner afin de s’assurer qu’aucune journée n’était perdue tout en s’assurant simultanément que la qualité du produit et des dossiers répondait aux attentes rigoureuses tant au sein de l’entreprise que au sein de la communauté réglementaire mondiale. À ce jour, le vaccin Pfizer-BioNTech et son vaste réseau de fabrication et de test ont été soumis et autorisés ou approuvés par plus de 170 pays et territoires.