
Explorer
Himanshu Brahmbhatt regardait les résultats d’un essai clinique qui semblaient trop beaux pour être vrais. Co-fondateur et PDG d’EnGeneIC, une société biopharmaceutique, Brahmbhatt menait un petit essai qui testait une approche fondamentalement différente de la lutte contre le cancer. Les patients du groupe avaient de sombres perspectives. Ils avaient épuisé toutes les autres options. N’ayant plus rien à perdre et ne s’attendant à aucun miracle, ils se sont inscrits au procès. Ils voulaient lui donner une chance de plus. Maintenant, leurs analyses ont montré que leurs tumeurs avaient cessé de progresser. Encore plus remarquable, ils n’avaient pas le même type de tumeurs. Ils avaient des tumeurs malignes affectant différents organes – poumons, vessie, côlon, pancréas – et pourtant, ils s’en sortaient bien.
« Ces personnes risquaient la mort », dit Brahmbhatt. “Ensuite, nous avons commencé à voir qu’ils réussissaient réellement. Vous pouvez voir sur le scanner que la tumeur a cessé de croître. C’était un sentiment de joie intérieure si extrême qu’il est très difficile de le décrire.
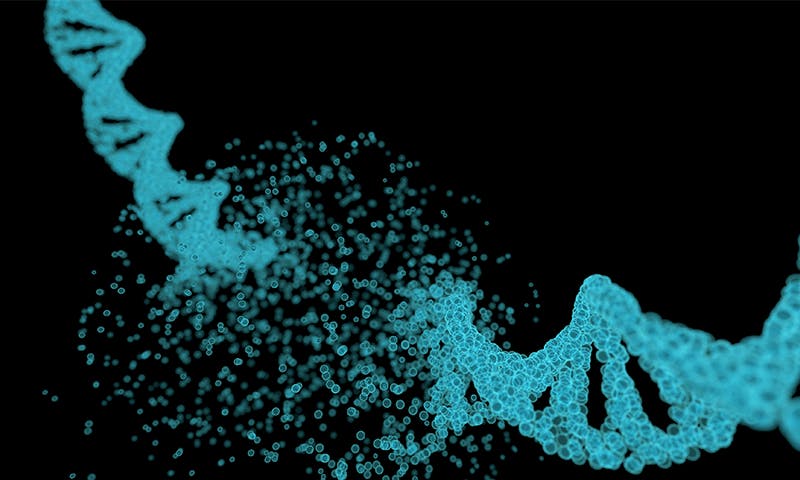
Les résultats ont peut-être semblé miraculeux, mais ils étaient tout sauf cela. Ils sont issus de la recherche fondamentale sur la division cellulaire qui est à la base du procédé EnGeneIC. Conseiller de longue date de la société, Bruce Stillman, professeur de biochimie et président-directeur général du Cold Spring Harbor Laboratory, a étudié le processus de réplication de l’ADN, qui joue un rôle clé dans la division cellulaire et la progression du cancer.

«Les cellules cancéreuses se multiplient de manière incontrôlable», explique Stillman, qui a consacré sa carrière à l’étude de la réplication de l’ADN. « Lorsqu’une cellule devient une cellule cancéreuse, la toute première chose qui se passe est que les cellules commencent à se diviser sans les contrôles normaux. Et la première chose qui doit se produire avant que la cellule ne doive se diviser en deux cellules filles est de copier le génome. Ainsi, la voie qui mène au cancer est en partie une dérégulation du processus qui contrôle la réplication de l’ADN. La réplication anormale de l’ADN provoque l’accumulation de mutations dans le génome qui fait progresser le cancer. Interférer avec le processus de division cellulaire est depuis longtemps une priorité pour le traitement du cancer, mais comme la division cellulaire normale est également inévitablement affectée, bon nombre de ces chimiothérapies sont toxiques. EnGeneIC a trouvé un moyen de contourner ce problème en combinant une nouvelle méthode d’administration de médicaments avec un moyen d’arrêter la réplication de l’ADN.
Stillman était un étudiant diplômé lorsqu’il a compris que la division cellulaire, et la réplication de l’ADN en particulier, étaient des cibles clés pour le traitement du cancer. Cette idée l’a inspiré à changer de carrière, passant de la médecine à la recherche médicale. À l’époque, la science de l’ADN était un domaine en plein essor et il y avait beaucoup à découvrir. Stillman était un pionnier. Il a découvert de nombreux mystères du processus de réplication du génome et ce qui met en marche la machinerie de copie. Il a passé 40 ans à assembler les pièces du puzzle moléculaire. « Je voulais comprendre comment ce processus fonctionne vraiment », dit-il. Et il l’a fait.
réeep à l’intérieur des dizaines de billions de cellules qui composent votre corps, la machinerie de réplication de l’ADN s’accélère constamment dans de nombreux tissus. Dans la seule moelle osseuse, 500 millions de globules rouges et blancs sont produits chaque minute. Il y a environ deux mètres d’ADN dans chaque cellule, soigneusement tissé à l’intérieur du noyau. Pour maintenir la stabilité de l’approvisionnement en cellules sanguines, environ un milliard de mètres d’ADN doivent être copiés chaque minute. “Vous pourriez enrouler cela autour de la Terre le long de l’équateur environ 25 fois”, explique Stillman. Il est inévitable qu’au cours de la vie d’une personne, ce processus fasse des erreurs, certaines inoffensives, mais d’autres conduisant à des mutations malignes. Ainsi, comprendre les rouages de cette machinerie complexe pourrait être la clé de la lutte contre de nombreux cancers.
Stillman et son équipe ont découvert que le processus de réplication commence par un ensemble de six protéines spécifiques appelées Origin Recognition Complex, ou ORC. Les protéines se lient à l’ADN à des endroits spécifiques et recrutent plus de protéines pour aider, formant ce qu’on appelle le complexe pré-réplicatif. Ce complexe pré-réplicatif “donne la permission” de démarrer la réplication de l’ADN et de nombreuses protéines commencent à copier le matériel génétique à partir de leurs points de départ respectifs. Une fois le travail terminé, le complexe pré-réplicatif est détruit. Une fois que la cellule est prête à se diviser à nouveau, le complexe se forme à nouveau.
Ils ont envoyé un cheval de Troie dans les cellules et ont retourné la supercherie du cancer contre lui.
Le groupe de Stillman a d’abord découvert l’ORC dans la levure, en expérimentant une souche appelée Saccharomyces cerevisiae, normalement utilisé pour faire du pain, du vin et de la bière. (Notamment, en 2020, il a remporté un prix Heineken de biochimie et de biophysique pour son travail, même si cela n’avait rien à voir avec le brassage – les prix sont décernés aux personnalités de premier plan dans les disciplines ci-dessus ainsi que dans l’art, la médecine , histoire et sciences environnementales et cognitives.) Alors que l’équipe de Stillman continuait d’étudier le phénomène ORC, ils ont réalisé que cet ancien processus fonctionnait de manière très similaire chez les humains. “Il est remarquable de penser que la levure et les humains partagent le même processus de réplication de l’ADN”, déclare Stillman. “Nous avons commencé avec des cellules de levure et nous avons pu suivre l’évolution et finalement arriver aux gènes humains.”
Un autre acteur clé de la réplication de l’ADN est une enzyme appelée ADN polymérase. Les ADN polymérases synthétisent le nouvel ADN en ajoutant des nucléotides – les éléments constitutifs du gène – un par un à la chaîne d’ADN en croissance. “Il y a environ 15 polymérases impliquées dans cette procédure”, explique Brahmbhatt. “Chacune de ces polymérases fait un travail différent dans ce processus de réplication de l’ADN.” Si certains d’entre eux cessent de fonctionner, la cellule ne pourra pas se diviser.
Connaître les points clés de la réplication de l’ADN a permis aux scientifiques de réfléchir aux moyens de bloquer les engrenages de copie à l’intérieur des cellules voyous. Au niveau biochimique, le brouillage des engins n’est pas une tâche insurmontable – aujourd’hui, les scientifiques peuvent forger une petite molécule qui peut se lier à certains joueurs et les « désactiver ». Le véritable défi était de livrer ces molécules à l’intérieur des cellules cancéreuses et pas d’autres. Si ces molécules se retrouvaient à l’intérieur de cellules saines, elles stopperaient les processus normaux de réplication, tuant les cellules et la personne avec elles.
SLes scientifiques savent que les cancers ont une étrange capacité à voyager à travers le corps en se glissant dans et hors des vaisseaux sanguins pour se frayer un chemin dans la circulation sanguine. Ils le font en desserrant les parois artérielles et en se faufilant à travers. “Normalement, les parois de nos vaisseaux sanguins sont toutes des tuyaux scellés”, explique Brahmbhatt. « Mais partout où le cancer se développe, les vaisseaux sanguins sont connus pour être très défectueux. Ils ont beaucoup de trous. »
Brahmbhatt et sa collaboratrice Jennifer MacDiarmid ont imaginé un stratagème astucieux. Ils enverraient un cheval de Troie dans les cellules malignes et retourneraient la ruse du cancer contre elle.
Le cheval de Troie, dans ce cas, est le produit d’une bactérie inoffensive qui a été génétiquement modifiée pour avoir des qualités spécifiques. Lorsque cette bactérie génétiquement modifiée se divise, elle produit une minuscule cellule non vivante de 400 nanomètres de diamètre, la bonne taille pour se glisser à travers les vaisseaux endommagés et se mêler aux tumeurs. À la nano-cellule, Brahmbhatt et MacDiarmid ont apposé un “crochet moléculaire” que la tumeur saisit et avale. La nano-cellule est également emballée avec des molécules d’ARN «interférentes» – des parents éloignés des ARN utilisés pour créer les premiers vaccins contre les coronavirus. Connues sous le nom de siARN, les molécules interfèrent avec l’expression de gènes spécifiques. Ils peuvent cibler certaines des enzymes de réplication de l’ADN et inhiber leur fonction. Brahmbhatt dit que Stillman a fourni des conseils inestimables sur les polymérases à cibler pour tuer les tumeurs malignes.
C’était un sentiment de joie si extrême qu’il est difficile de le décrire.
Brahmbhatt et MacDiarmid ont testé les assassins de nano-cellules sur des souris, puis dans un petit essai sur l’homme. “Il y avait une grande peur au début”, dit Brahmbhatt. “Tout le monde avait peur parce que ces molécules n’avaient jamais été envoyées spécifiquement dans un être humain, et tout le monde savait que si cette chose pénètre dans les mauvaises cellules, c’est-à-dire dans le Ordinaire cellules – cela pourrait être fatal. C’est pourquoi la première cohorte de l’étude ne comprenait que des personnes qui avaient épuisé toutes les autres options.
Lorsqu’il a regardé la première série de scans, se souvient Brahmbhatt, “ce que nous avons vu était quelque chose de fantastique. Avec ces molécules, qui sont des inhibiteurs de la réplication de l’ADN, nous pourrions prolonger leur durée de vie. Plus surprenant était le fait que, contrairement aux chimiothérapies systémiques, il n’y avait pas d’effets secondaires toxiques. Actuellement, la société de Brahmbhatt, EnGeneIC, se prépare pour la prochaine phase des essais cliniques.
Si la méthode siRNA fait ses preuves dans des essais plus importants, l’impact sur la santé publique sera bien plus important que la simple mise sur le marché d’un autre composé anticancéreux. Le retard de réplication de l’ADN a le potentiel de devenir le traitement universel du cancer. Les recherches menées par Stillman, ainsi que d’autres qui ont choisi d’étudier la biologie fondamentale de la réplication de l’ADN, portent désormais non seulement leurs fruits, mais, combinées au bon système d’administration, ont le potentiel de changer le paradigme du traitement du cancer. Et c’est la beauté et l’importance de la recherche fondamentale, sans laquelle les applications cliniques modernes seraient impossibles. “Aujourd’hui, ces découvertes sont devenues critiques”, déclare Brahmbhatt. « Si cela fonctionne, nous ne guérirons pas seulement un type de cancer. Nous guéririons le cancer à tous les niveaux.
![]()
Image principale : Bawan / Shutterstock
-
Lina Zeldovitch
Publié le 5 octobre 2022
Lina Zeldovich a grandi dans une famille de scientifiques russes, écoutant au coucher des histoires sur les volcans, les trous noirs et les explorateurs intrépides. Elle a écrit pour Le New York Times, Scientifique Américain, Reader’s Digestet Audubon Magazine, entre autres publications, et a remporté quatre prix pour avoir couvert la science du caca. Son livre, L’autre matière noire : la science et le commerce de la transformation des déchets en richesse, a été publié en 2021 par Chicago University Press. Vous pouvez la trouver sur LinaZeldovich.com et @LinaZeldovich.
Publié en partenariat avec :
Recevoir la newsletter Nautilus
Les articles les plus récents et les plus populaires livrés directement dans votre boîte de réception !





![Toyota lance un nouveau SUV « Série Land Cruiser « 250 » »[Actualités]- webCG](https://www.webcg.net/mwimgs/9/e/-/img_9eed70d12820b9d8221746fcee16b3fb298896.jpg)



