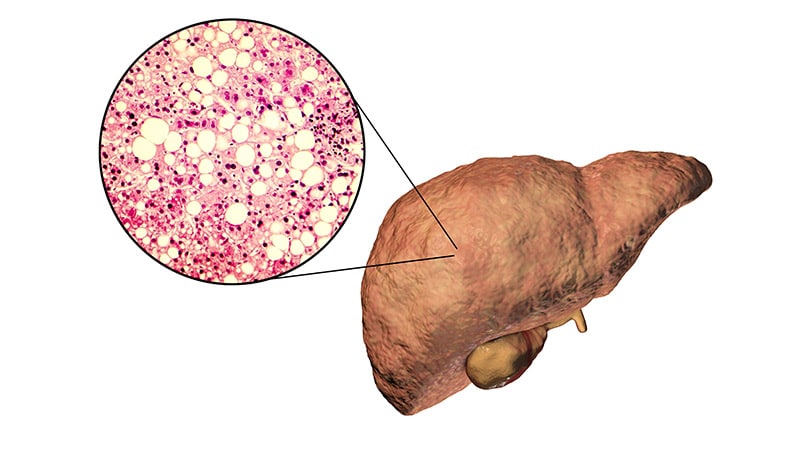
La Food and Drug Administration (FDA) des États-Unis a rejeté la deuxième offre d’Intercept Pharmaceutical pour l’approbation de acide obéticholique (OCA) pour le traitement de stéatohépatite non alcoolique (NASH) avec fibrose de stade 2 ou 3.
Cette décision fait suite à la recommandation de la réunion du mois dernier du comité consultatif sur les médicaments gastro-intestinaux de la FDA. Au cours de la réunion, les membres voté 15 contre 1 conseiller de différer l’approbation jusqu’à ce que les données sur les résultats cliniques soient disponibles. Les données des essais cliniques d’Intercept ont démontré que l’OCA a montré un avantage modéré par rapport au placebo dans l’amélioration de la fibrose chez les patients NASH, mais “il existe une incertitude quant à la manière dont l’ampleur des changements dans ces paramètres de substitution peut se traduire par des changements significatifs dans les résultats cliniques”, a déclaré la FDA. document d’information de la réunion déclaré. Il y avait également des problèmes de sécurité notables, notamment un risque accru de lésions hépatiques d’origine médicamenteuse.
On estime que 16,8 millions d’Américains sont atteints de NASH, et il n’existe aucun médicament approuvé par la FDA pour cette maladie.
Pour plus d’informations, suivez Medscape sur Facebook, Twitter, Instagram, Youtubeet LinkedIn
Crédits:
Image principale : Katerina Kon/Le temps des rêves
© 2023 WebMD, LLC
Envoyez des conseils d’actualité à [email protected].
Citer ceci : La FDA rejette le médicament NASH pour la deuxième fois – Paysage médical – 22 juin 2023.