La Food and Drug Administration a accepté une nouvelle demande de médicament pour le gel de berdazimer 10,3% pour le traitement du molluscum contagiosum, a annoncé le fabricant le 7 mars.
S’il est approuvé, le gel de berdazimer serait le premier produit sur ordonnance approuvé par la FDA pour le molluscum contagiosum aux États-Unis, selon la société Novan. L’ingrédient actif du gel de berdazimère à 10,3 % est le berdazimère sodique, un nouvel agent libérant de l’oxyde nitrique.
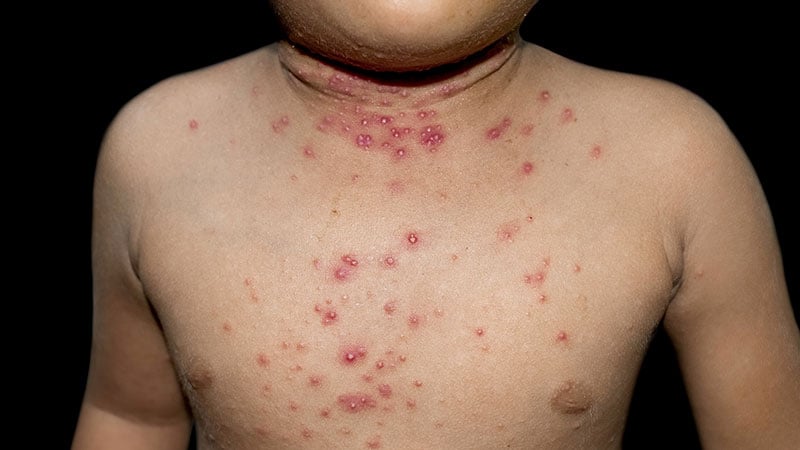
Le molluscum contagiosum est une infection cutanée bénigne mais contagieuse caractérisée par des papules rouges sur le visage, le tronc, les membres et les aisselles qui peuvent persister pendant des années si elles ne sont pas traitées.
Le traitement a été évalué dans l’étude B-SIMPLE4, un essai clinique de phase 3 incluant 891 personnes atteintes de molluscum contagiosum âgées de 6 mois et plus, avec 3 à 70 lésions surélevées L’âge moyen des patients était d’environ 7 ans (extrêmes, 0,9-47,5 ans) et 85,5 % étaient blancs (4,7 % étaient noirs, 21,2 % étaient hispaniques et 1,4 % étaient asiatiques). Les participants à l’étude ont été randomisés pour recevoir un gel de berdazimer à 10,3 % ou un gel véhicule appliqué en couche mince sur toutes les lésions une fois par jour pendant 12 semaines.
Les résultats complets de l’étude B-SIMPLE4 ont été publiés dans JAMA Dermatology en juillet 2022. Après 12 semaines de traitement, 32,4 % des patients du groupe berdazimer ont atteint le critère principal de disparition complète de toutes les lésions, contre 19,7 % de ceux du groupe berdazimer. véhicule (P < .001). Les taux d'événements indésirables étaient similaires et faibles dans les deux groupes. Les événements indésirables les plus fréquents dans les deux groupes étaient la douleur et l'érythème au site d'application, et la plupart des cas étaient légers ou modérés. Au total, 4,1 % des patients sous berdazimer et 0,7 % des patients sous placebo ont présenté des événements indésirables ayant entraîné l'arrêt du traitement.
La date cible des frais d’utilisation des médicaments sur ordonnance pour l’approbation du berdazimer 10,3 % pour le molluscum contagiosum est fixée au 5 janvier 2024, selon Novan.
Cet article a été initialement publié sur MDedge.com, qui fait partie du réseau professionnel Medscape.