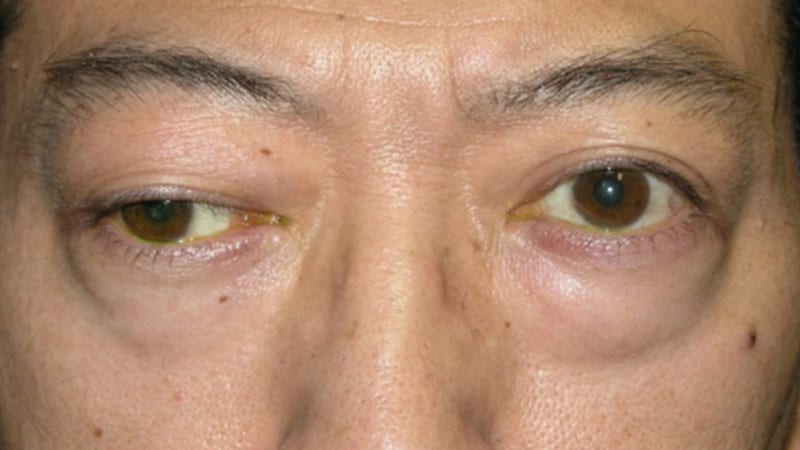
La Food and Drug Administration (FDA) des États-Unis a approuvé le rozanolixizumab (Rystiggo) pour traiter les adultes atteints de myasthénie grave (gMG) qui sont positifs pour l’anticorps anti-récepteur de l’acétylcholine (AChR) ou anti-tyrosine kinase spécifique du muscle (MuSK), a annoncé le fabricant du médicament, UCB.
La gMG est une maladie auto-immune rare de la jonction nerf-muscle. Les gMG positives aux anticorps anti-AChR et anti-MuSK sont les deux sous-types les plus courants. Le rozanolixizumab est le premier traitement approuvé par la FDA pour les adultes atteints des deux sous-types.
Le rozanolixizumab est un anticorps monoclonal IgG4 humanisé infusé par voie sous-cutanée qui se lie au récepteur Fc néonatal (FcRn), réduisant ainsi la concentration d’auto-anticorps IgG pathogènes.
L’approbation américaine est basée sur les résultats de l’étude de phase 3 MycarinG portant sur 200 patients atteints de gMG à auto-anticorps anti-AChR ou MuSK. Les patients ont été assignés au hasard à l’un des deux groupes de rozanolixizumab (7 mg/kg ou 10 mg/kg) ou de placebo pendant 6 semaines.
Comme rapporté le mois dernier dans Lancet Neurologiele rozanolixizumb a entraîné des améliorations statistiquement significatives des résultats spécifiques au gMG, y compris les activités quotidiennes telles que respirer, parler, avaler et être capable de se lever d’une chaise.
“Il existe un besoin important de nouvelles options de traitement innovantes pour réduire le fardeau quotidien de la gMG”, a déclaré la chercheuse principale Vera Bril, MD, professeure de médecine (neurologie), Université de Toronto, Canada, dans un communiqué de presse. .
Le rozanolixizumab est “une nouvelle option de traitement, ciblant l’un des mécanismes de la maladie pour apporter une amélioration des symptômes dans les résultats rapportés par les patients et les médecins au jour 43”, a ajouté Bril.
Les effets indésirables les plus fréquents (rapportés chez au moins 10 % des patients traités par rozanolixizumab) étaient mal de têteinfections, diarrhéepyrexie, réactions d’hypersensibilité et nausées.
La société s’attend à ce que le rozanolixizumab soit disponible aux États-Unis au cours du troisième trimestre 2023.
La FDA a accordé la demande de rozanolixizumab dans l’examen prioritaire du gMG.
Pour plus d’informations sur Medscape Neurology, rejoignez-nous sur Facebook et Twitter