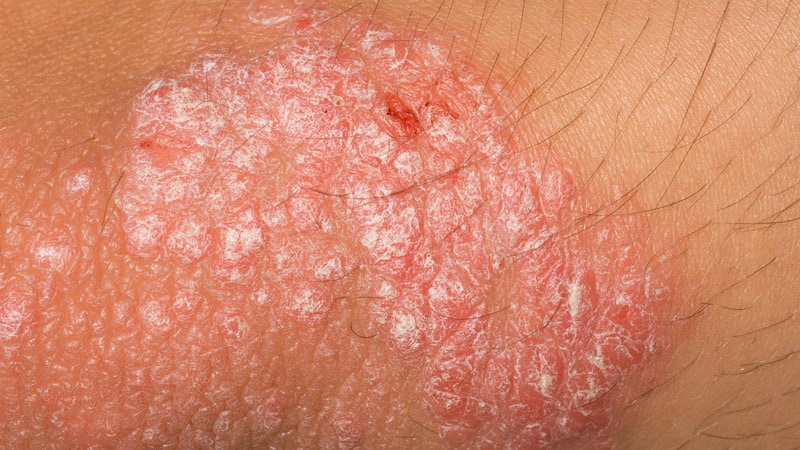
La Food and Drug Administration (FDA) des États-Unis a approuvé la crème de roflumilast à 0,3 % pour le traitement topique du psoriasis en plaques, « y compris les zones intertrigineuses », chez les patients âgés de 12 ans et plus.
Le roflumilast est un inhibiteur sélectif de la phosphodiestérase 4 (PDE4), le premier approuvé pour le traitement du psoriasis, selon le fabricant Arcutis Biotherapeutics. La société a annoncé l’approbation le 29 juillet. Roflumilast oral ( Daliresp ) a été approuvé en 2011 pour le traitement de la maladie pulmonaire obstructive chronique (MPOC).
“C’est une thérapie topique révolutionnaire”, déclare Mark G. Lebwohl, MD, doyen de la thérapeutique clinique et professeur de dermatologie, Icahn School of Medicine à Mount Sinai, New York, et chercheur principal dans les essais sur le roflumilast topique. Dans une interview, Lebwohl a noté que le traitement réduisait considérablement les symptômes du psoriasis dans les essais à court et à long terme.
En outre, deux caractéristiques de ce traitement le distinguent des autres traitements topiques du psoriasis, a-t-il déclaré. Le roflumilast n’est pas un stéroïde, il ne présente donc pas de risque d’effets secondaires liés aux stéroïdes topiques associés à une utilisation chronique et, dans les essais cliniques, le roflumilast topique s’est avéré efficace dans le traitement du psoriasis dans les zones intertrigineuses, y compris les fesses, les aisselles et sous le seins, qui sont difficiles à traiter.
L’approbation de la FDA est basée sur les données de deux essais randomisés de phase 3, en double aveugle et contrôlés par véhicule, selon Arcutis. Le critère d’évaluation principal était le succès de l’évaluation globale de l’investigateur (IGA), défini comme clair ou presque clair avec une amélioration d’au moins 2 grades par rapport à la ligne de base et une amélioration d’au moins 2 grades du score IGA par rapport à la ligne de base à 8 semaines.
À 8 semaines, 42,4 % et 37,5 % des patients traités par roflumilast topique ont obtenu un taux de réussite de l’IGA contre 6,1 % et 6,9 % dans les groupes témoins, respectivement (P .0001 pour les deux études).
Les patients traités ont également connu des améliorations significatives par rapport à ceux des groupes excipients dans les critères d’évaluation secondaires des essais : ceux-ci comprenaient le succès de l’IGA intertrigineux (I-IGA), l’indice de gravité de la zone de psoriasis-75 (PASI-75), la réduction des démangeaisons sur la base de la pire Échelle d’évaluation numérique des démangeaisons (WI-NRS) et journal des symptômes de psoriasis autodéclarés (PSD).
Dans les études, 72 % et 68 % des patients traités par roflumilast ont atteint le critère I-IGA à 8 semaines contre 14 % et 17 %, respectivement, de ceux sous véhicule (P < 0,0001 pour les deux études).
De plus, à la semaine 2, certains participants traités avec du roflumilast avaient ressenti une réduction des démangeaisons dans les deux études. A 8 semaines, parmi ceux ayant un score WI-NRS de 4 ou plus au départ, 67% et 69% des patients traités avaient au moins une réduction de 4 points du WI-NRS versus 26% et 33%, respectivement, parmi ceux à bord du véhicule (P < 0,0001 pour les deux études), selon la société.
En général, la crème a été bien tolérée. Des cas de diarrhée (3 %), de maux de tête (2 %), d’insomnie (1 %), de nausées (1 %), de douleur au site d’application (1 %), d’infections des voies respiratoires supérieures (1 %) et d’infections des voies urinaires ont été signalés. (1%). Cependant, Lebwohl note que ces événements ont également été observés dans le groupe témoin.
“L’étude était sans équivoque sur l’amélioration des sites intertrigineux”, a commenté Lebwohl. Il compare cela aux données d’autres topiques non stéroïdiens, qui, selon lui, peuvent être associés à une éruption cutanée ou à une irritation dans les zones sensibles.
Lebwohl a noté que la PDE4 est une enzyme qui augmente l’inflammation et diminue les médiateurs anti-inflammatoires et que l’inhibition de la PDE4 peut interrompre une partie de la réponse inflammatoire responsable des symptômes du psoriasis, comme c’est le cas pour d’autres affections comme la dermatite atopique. Les données des essais de phase 3 de 8 semaines et des études ouvertes de phase 2b d’une durée d’un an étayent cette hypothèse.
“Je suis toujours enthousiaste à l’idée que de nouveaux traitements contre le psoriasis élargissent notre arsenal thérapeutique”, a déclaré Lauren E. Ploch, MD, dermatologue qui exerce à Augusta, en Géorgie, et à Aiken, en Caroline du Sud, à qui on a demandé de commenter l’approbation.
Même un symptôme qui semble bénin, comme des démangeaisons, a ajouté Ploch, peut entraîner une réduction du sommeil et une irritabilité accrue. Se référant aux données sur le traitement dans les zones sensibles et intertrigineuses, elle a noté que la peau dans ces zones est souvent plus fine, de sorte que le traitement avec des stéroïdes peut provoquer un amincissement et des dommages supplémentaires à la peau. Si le roflumilast ne provoque pas de brûlures, de démangeaisons ou d’amincissement, ce sera une excellente option pour traiter ces zones, a-t-elle déclaré lors d’une interview. Elle n’a pas participé aux essais.
La crème Roflumilast sera commercialisée sous le nom commercial de Zoryve et devrait être disponible d’ici la mi-août, selon Arcutis.
La crème de roflumilast est également à l’étude au Canada pour le traitement du psoriasis en plaques chez les adultes et les adolescents.
Les études ont été financées par Arcutis Biotherapeutics. Lebwohl a déclaré avoir reçu des subventions et des honoraires de conseil d’Arcutis. Ploch ne signale aucune relation financière pertinente.
Pour plus d’actualités, suivez Medscape sur Facebook, TwitterInstagram, YouTube et LinkedIn.





![Nature Haru, soupçonné de travailler dans un établissement de divertissement japonais… “Je ne peux pas encore vous dire ce que je veux dire, s’il vous plaît, attendez.” [MD이슈]](https://mydaily.co.kr/photos/2024/04/26/2024042617451063126_l.jpg)



